Más Información

Caso Cecilia Monzón: Sentencian a 60 años de prisión a Javier López, por feminicidio de la activista; fue secretario de Gobierno en Puebla

Rifas ilegales, posible causa del ataque a empresario del Mercado de Abastos en Zapopan: Secretario de Gobierno de Jalisco
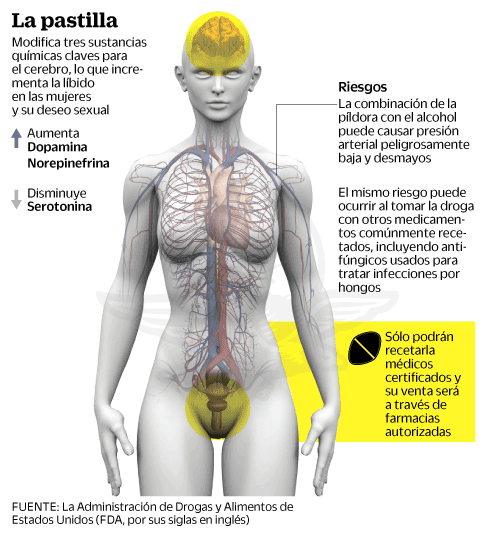
La Administración de Drogas y Alimentos de Estados Unidos (FDA, por sus siglas en inglés) aprobó ayer la comercialización del “viagra femenino”, el primer fármaco de prescripción diseñado para aumentar el deseo sexual en las mujeres, un hito largamente buscado por la industria farmacéutica con ganas de repetir el éxito de la superproducción de medicamentos contra la impotencia en los hombres.
Pero las estrictas medidas de seguridad sobre la píldora podrían provocar que no se alcancen las ventas similares a las del viagra para hombre, que ha generado miles de millones de dólares de ganancias desde finales de 1990.
La comercialización de la flibanserina, que se convertirá en la primera píldora en el mercado que incrementa el deseo sexual de la mujer, se convirtió en una realidad, después de que un panel de expertos recomendara su aprobación en junio, y permitirá que estas pequeñas píldoras de color rosa estén disponibles en las farmacias estadounidenses a partir del 17 de octubre bajo el nombre comercial de Addyi.
La etiqueta médica de advertencia será del tipo más grave, los médicos deben emitir una alerta a los pacientes respecto a que la combinación de la píldora con el alcohol puede causar presión arterial peligrosamente baja y desmayos. El mismo riesgo puede ocurrir al tomar la droga con otros medicamentos comúnmente recetados, incluyendo antifúngicos usados para tratar infecciones por hongos.
“Esto no es un medicamento que se pueda tomar una hora antes de tener sexo. Hay que tomarla durante semanas y meses”, dijo Leonore Tiefer, un terapeuta y sicólogo del sexo que organizó una petición el último mes en la FDA para rechazar la droga.
La píldora Addyi servirá para tratar el trastorno del deseo sexual hipoactivo (TDSH) en mujeres premenopáusicas, informó la FDA en un comunicado.
“La aprobación de este día ofrece a las mujeres angustiadas por su bajo deseo sexual una opción de tratamiento”, dijo Janet Woodcock, directora del Centro para Evaluación e Investigación de Medicamentos de la FDA.
“Debido a una interacción potencialmente grave con alcohol, el tratamiento con Addyi sólo estará disponible a través de profesionales de la salud certificados y farmacias autorizadas. Los pacientes y los médicos prescriptores deben comprender totalmente los riesgos asociados con el uso de Addyi antes de considerar el tratamiento”, indicó la doctora Woodcock.
¿Cómo funciona? Este viagra femenino modifica tres sustancias químicas claves para el cerebro, aumentando la dopamina y la norepinefrina y disminuyendo la serotonina, lo que hace incrementar la libido en las mujeres y su deseo sexual.
El medicamento, que comercializará Sprout Pharmaceuticals, está pensado para ser administrado diariamente a mujeres premenopáusicas que sufran un desorden de anorexia sexual, es decir, la pérdida repentina de cualquier deseo de practicar sexo.
“La FDA se esfuerza por proteger y promover la salud de las mujeres, y estamos comprometidos a apoyar el desarrollo de tratamientos seguros y eficaces para la disfunción sexual femenina”, añadió Woodcock en un comunicado.
El fármaco ha sido objeto de debate durante varios meses, ya que la Organización Nacional para la Mujer y otras asociaciones feministas acusaron a la FDA de estar sometiendo a mayores escrutinios esta medicación que las diseñadas para incrementar la libido masculina, como Viagra y Cialis.
Los principales responsables del atraso en su aprobación han sido los efectos secundarios, que en este caso son posibles desmayos y disminución de la presión arterial, riesgos que aumentan con el consumo de alcohol y con el uso de otros medicamentos que interfieren con la descomposición de Addyi en el organismo.
La FDA rechazó en otras dos ocasiones anteriores el compuesto, después de que otros paneles de asesoría concluyeran que había dudas sobre su seguridad, y no consideraba que hubiera pruebas suficientes que demostraran que el fármaco es eficaz.
Con información de EFE
Noticias según tus intereses
[Publicidad]
[Publicidad]










